Neugeborenen-Screening
Vollblut auf Filterkarte
Neugeborenen-Screening auf angeborene Störungen des Stoffwechsels, des Hormon-, Blut-, und Immunsystems, des neuromuskulären Systems und auf Mukoviszidose
Die Früherkennungsuntersuchung zwischen 36 und 48 (bis 72) Lebensstunden umfasst Screening auf Aminoazidopathien, Organoazidurien, Störungen im Transport und Abbau von Fettsäuren, Galaktosämie, Biotinidase-Mangel, Hypothyreose, AGS, Immundefekte (SCID), Sichelzellkrankheit, spinale Muskelatrophie (SMA) und Mukoviszidose (CF).
Das Neugeborenen-Screening dient der Früherkennung behandelbarer Störungen, die zu geistigen und körperlichen Behinderungen und auch zum Tod führen können, wenn die Behandlung zu spät oder gar nicht einsetzt. Das Modellprojekt zur Neuordnung des Neugeborenen-Screening in Bayern, das am 1. Januar 1999 gestartet wurde, beinhaltete eine deutliche Erweiterung des Untersuchungsumfangs, neue Untersuchungsmethoden sowie Maßnahmen zur Verbesserung der Prozessqualität. Die Laboruntersuchungen dieses Pilotprojektes wurden zentral für ganz Bayern in unserem Labor durchgeführt. Die Ergebnisse haben wesentlich zur bundesweiten Einführung des erweiterten Screening als Regelleistung zum 1. Juli 2005 beigetragen.
Durch das Vorsorgezentrum des öffentlichen Gesundheitsdienstes wurde ein Tracking-System aufgebaut, das die vollständige Untersuchung aller Neugeborenen und ggf. die Nachsorge bei auffälligen (positiven) Befunden in Bayern sicherstellt. Die Nachverfolgung kontrollbedürftiger Fälle außerhalb Bayerns erfolgt durch das LABOR.
Aktuell nutzt die überwiegende Mehrzahl der Geburtshilfeeinrichtungen in Bayern sowie eine große Anzahl der Geburtshilfeeinrichtungen in Nordrhein-Westfalen (NRW) unser Angebot.
Umfang und Durchführung des Neugeborenen-Screening sind in der sogenannten "Kinder-Richtlinie" (Richtlinie zur Früherkennung von Krankheiten bei Kindern) des gemeinsamen Bundesausschusses (g-BA) geregelt.
Elterninformation: Die Teilnahme am Neugeborenen-Screening ist freiwillig. Deshalb ist die schriftliche Einwilligung eines/r Sorgeberechtigten notwendig. Grundsätzlich gelten für das Screening die Regularien des Gendiagnostikgesetzes. Die Einwilligung ist zum einen für die Durchführung der Untersuchung selbst erforderlich (medizinischer Eingriff) und zum anderen für die Datenübermittlung beim Tracking (datenschutzrechtlicher Eingriff). In Anbetracht des hohen Nutzens bei nur minimalem Risiko (kapilläre Blutennahme aus der Ferse) stimmen nahezu alle Eltern von Neugeborenen dem Screening zu.
Zur Information der Eltern stehen Broschüren mit dem Titel „Elterninformation zum Neugeborenen-Screening“ zur Verfügung. Es bietet sich an, diese Broschüren mit anliegender Einwilligungserklärung schon bei der Aufnahme in die Geburtsklinik auszuhändigen. Die ausgefüllten und unterschriebenen Einwilligungserklärungen werden dann zur Patientenakte genommen und verbleiben dort. Sie sollen nicht ins Labor oder an das Vorsorgezentrum geschickt werden.
Zeitpunkt der Probennahme: Oberstes Ziel ist die frühestmögliche Erkennung betroffener Kinder, um diese umgehend einer Behandlung zuzuführen. Der optimale Zeitpunkt der Blutabnahme liegt zwischen 36 und 48 Lebensstunden ([bis 72)] siehe Kinder-Richtlinie §8 (1)). Spätere Abnahmen und damit eine verzögerte Therapie-Einleitung können bei einzelnen Störungen gravierende Folgen nach sich ziehen.
Auch bei ambulanter Entbindung bzw. Frühentlassung aus der Geburtsklinik innerhalb der ersten 36 Lebensstunden, bei Verlegung in eine andere Institution oder bei Bluttransfusion, Corticoid-, Katecholamin-Gabe oder bei Zufuhr aminosäurenhaltiger Infusionen soll immer vorher eine Probe entnommen werden. Die meisten der untersuchten Erkrankungen, insbesondere diejenigen, die zu akuten Stoffwechselentgleisungen führen können, werden nach derzeitigem Kenntnisstand schon wenige Stunden nach der Geburt erkannt. Um eine Zeitverzögerung zu vermeiden, arbeitet das Screeninglabor auch am Wochenende und an Feiertagen.
Aus Sicherheitsgründen muss bei einem Screening vor dem Alter von 36 Lebensstunden eine weitere Screening-Untersuchung im Rahmen der U2 durchgeführt werden (Zweitscreening). Hierfür ist den Eltern eine Zweitkarte (ohne Barcode) mitzugeben. Bei sehr unreifen Kindern (weniger als 32 Schwangerschaftswochen) muss zusätzlich zum Erstscreening ein abschließendes Zweitscreening in einem korrigierten Alter von 32 Schwangerschaftswochen erfolgen (siehe Kinder-Richtlinie §8 Satz 4).
Sofern vor dem Alter von 36 Lebensstunden eine Transfusion, Corticoid- oder Katecholamin-Therapie notwendig ist, soll vor Beginn der Therapie bzw. vor Transfusion ein 1. Screening abgenommen werden. In diesem Fall sollte eine Kontrolle 5 Tage nach der letzten Transfusion bzw. Corticoid- oder Katecholamin-Gabe erfolgen. Sollte kein Screening vor Transfusion erfolgt sein, muss eine zweite Kontrolle zusätzlich 6 - 8 Wochen nach der letzten Transfusion erfolgen.
Um eine gleichbleibende Saugfähigkeit des Filterpapiers zu gewährleisten, müssen die Karten trocken gelagert und geschützt werden vor Kontakt mit Alkohol, Wasser, Handlotion, Puder etc.. Das Filterpapier darf nicht mit den Fingern angefasst werden.
Bitte kein Blut aus venösen Zugängen verwenden, weil schon geringe Infusionsreste die Ergebnisse verfälschen können. Nabelschnurblut ist für die Durchführung des Neugeborenen-Screenings nicht geeignet; die durchgeführten Untersuchungen sind nicht zuverlässig beurteilbar.
Beschriftung der Testkarte: Bitte verwenden Sie ausschließlich unsere Testkarten und die von uns versandten Barcodes. Die Karten müssen vollständige Angaben enthalten.
Die Angaben zum Neugeborenen, wie z.B. das Alter bei Probennahme, Gestationsalter und das Geburtsgewicht, sind für die richtige medizinische Bewertung einiger Parameter (z.B. AGS-Screening) dringend erforderlich. Wichtige anamnestische Angaben sind z.B. Frühgeburtlichkeit, Transfusionen, parenterale Ernährung, verabreichte Arzneimittel, bekannte Vorerkrankungen (z.B. Trisomie 21) oder positive Familienanamnese bezüglich einer der im Screening erfassten Erkrankungen.
Die Adresse und Telefonnummer der Mutter werden für eine eventuelle Kontaktaufnahme unbedingt benötigt. Einige der untersuchten Erkrankungen, z.B. klassische Galaktosämie, Organoazidopathien oder Störungen im Transport und Abbau von Fettsäuren, können innerhalb von Stunden zu lebensbedrohlichen Situationen für das Neugeborene führen und bedürfen der sofortigen, notfallmäßigen medizinischen Intervention. Wenn der Einsender der Testkarte nicht erreichbar ist, wird im Notfall versucht, die Eltern direkt zu kontaktieren.
Zweitkarten (z.B. zweite Abnahme wegen erster Abnahme vor dem Alter von 36 Stunden) bitte entsprechend kennzeichnen (vorgesehenes Feld ankreuzen) und neuen Barcode verwenden. Bei vom Screeninglabor angeforderten Kontrolluntersuchungen (bitte Feld "Kontrollkarte" rechts auf der Karte ankreuzen) sollte die Auftragsnummer der Erstkarte angegeben werden. Es wird kein neuer Barcode vergeben. Wir können dann die Probe sofort dem Vorbefund zuordnen. Diese Kontrollen sind kostenfrei. Auf die Rückseite der Filterkarte sollten Sie Ihre Adresse stempeln, damit wir wissen, wer den Befund erhalten soll.
Blutentnahme (Handschuhe verwenden):
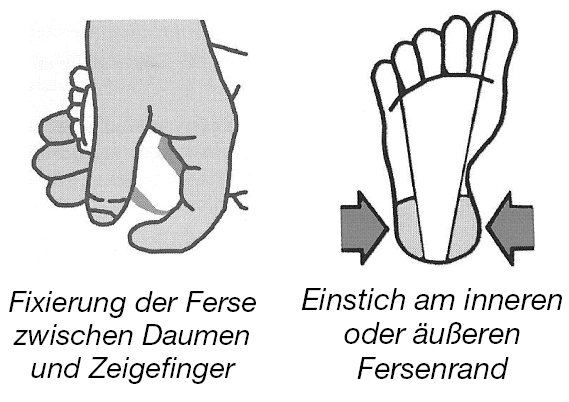
Probenversand: Für den Probenversand stellen wir Freiumschläge. Die Testkarten müssen vor dem Einpacken gut durchgetrocknet sein. Wenn mehrere Karten in einen Umschlag kommen, sollten diese alternierend gelegt werden (nicht Filterpapier auf Filterpapier). Die Umschläge müssen noch am Tag der Probennahme abgeschickt werden. Sie sollten in einen Briefkasten gesteckt werden, der noch am selben Tag geleert wird. Zeitverzögerungen beim Probenversand, z.B. durch Sammeln von Proben über Tage hinweg oder durch Umwege über hausinterne Verwaltungen, sollten unbedingt vermieden werden.
Die Testkarten sollten weder einzeln noch gesammelt in Plastiktüten gelagert oder transportiert werden. In diesen kann sich eine feuchte Atmosphäre ausbilden (z.B. durch Kondenswasser), die das Probenmaterial schädigt (Abbau empfindlicher Strukturen, z.B. Enzyme).
Sommerliche Temperaturen wirken sich nachteilig auf die Stabilität insbesondere von Enzymen (Gal-1-PUT, Biotinidase) aus. Längeres Lagern in sonnenbestrahlten Postkästen kann zu irreversiblen Veränderungen dieser Stoffe führen. Fehlbestimmungen durch Kälteeinfluss beim Transport in Wintermonaten sind dagegen nicht zu erwarten.
Dokumentation: Nach den Screening-Richtlinien der Fachgesellschaften und de Kinder-Richtlinie ist jede Stelle, die Screening-Untersuchungen veranlasst (Krankenhaus, Arzt), verpflichtet, die Blutentnahme, den Versand und den Befundrücklauf der Ergebnisse in einer Weise zu dokumentieren, dass Durchführung und Ergebnis des Screenings dem einzelnen Neugeborenen zugeordnet werden können. Wir liefern zur sicheren Dokumentation der Untersuchung mit den Testkarten Etikettensätze für die Testkarte, das Geburtenbuch und das gelbe Kinderuntersuchungsheft mit. Der Eingang der schriftlichen Befunde sollte dokumentiert werden, am besten im Geburtenbuch oder im Barcodeheft (dafür vorgesehenes Feld bei Befundeingang abhaken). Spätestens wenn zwischen Probenausgang und Befundrücklauf mehr als 8 Tage vergangen sind, sollte in unserem Screeninglabor (Tel. 089 544 654 0) oder bei bayerischen Einsendern auch im Screening-Zentrum im Bayerischen Landesamt für Gesundheit und Lebensmittelsicherheit (LGL; Service-Nummer: 09131 6808-5204 oder -5131) nachgefragt werden, um sicher zu gehen, dass keine Probe z.B. auf dem Postweg verlorengegangen ist. Das Etikett im Kinderuntersuchungsheft gibt dem weiterbehandelnden Kinderarzt die Gewissheit, dass das Screening durchgeführt wurde und erleichtert Nachfragen. In Bayern wurde durch das LGL ein Tracking-System aufgebaut. Die bei entsprechender Einwilligung der Eltern von uns an das LGL übermittelten Daten werden mit den Geburtenregistern der Standesämter abgeglichen. Die regionalen Gesundheitsämter nehmen dann gezielt Kontakt mit den Eltern nicht als untersucht gemeldeter Kinder auf, um auf die Bedeutung der Vorsorgemaßnahme nochmals hinzuweisen oder ggf. verloren gegangene Proben zu identifizieren. Die Bedeutung dieses aufwendigen Vorgangs wird deutlich, wenn man sich vor Augen führt, dass bei einer Gesamtinzidenz der gescreenten Erkrankungen von ca. 1 : 1300 bereits eine Rate von 1% nicht untersuchter Kinder zu einer vermeidbaren Behinderung pro Jahr in Bayern führt.
Nach der Kinder-Richtlinie umfasst das Neugeborenen-Screening in Deutschland 19 Zielerkrankungen. Häufigkeit, Hauptsymptome und Grundprinzipien der Therapie finden sich in folgender Tabelle:
| NEUGEBORENEN-SCREENING: ZIELKRANKHEITEN - SYMPTOME - BEHANDLUNG | |||
| Erkrankung | Häufigkeit | Hauptsymptome der unbehandelten Erkrankung |
Grundprinzipien der Behandlung |
|---|---|---|---|
| Kongenitale Hypothyreose (primäre Hypothyreose) | 1:3.500 | neonatal oft asymptomatisch oder Ikterus prolongatus, Muskelhypotonie, Trinkschwäche; später schwere Entwicklungsverzögerung, Wachstumsstillstand, Makroglossie, Obstipation | zeitlebens Substitution mit L-Thyroxin p.o. |
| Adrenogenitales Syndrom (AGS) | 1:13.000 | Virilisierung ± Salzverlustsyndrom (neonataler Beginn) | zeitlebens Substitution von Hydrocortison ± Mineralocorticoid |
| Biotinidasemangel | 1:82.000 | nach Aufbrauchen angeborener Biotinreserven ausgeprägte metabolische Azidose, Ataxie, Alopezie, Krampfanfälle | zeitlebens Gabe von täglich 5–10 mg Biotin p.o. |
| Galaktosämie | 1:55.000 | unter Milchzufuhr (Laktose) schwere Leberfunktionsstörung, Ikterus, Gerinnungsstörung, Hepatomegalie, Katarakt (neonataler Beginn), Entwicklungsretardierung | zeitlebens Lactose-freie, Galaktose-arme Ernährung |
| Phenylketonurie Hyperphenylalaninämie | 1:4.500 | Entwicklungsverzögerung, schwere Intelligenzminderung, Anfallsleiden | Phenylalanin-arme Diät, ggf. Gabe von Tetrahydrobiopterin |
| Ahornsiruperkrankung (MSUD) | 1:189.000 | Trinkschwäche, Somnolenz, Hypo- bis Areflexie, veränderter Muskeltonus, Krampfanfälle, respiratorische Insuffizienz, Koma, Maggi-ähnlicher Geruch (neonataler Beginn) | akut: Eiweißzufuhr stoppen, anabole Stoffwechselsituation herstellen, evtl. Dialyseverfahren; zeitlebens: Leucin-arme Diät |
| Medium-Chain-Acyl-CoA-Dehydrogenase-Mangel (MCAD-Mangel) | 1:9.000 |
Fieber, Erbrechen, Fasten führen zu Katabolie und Stoffwechselentgleisung mit hypoketotischer Hypoglykämie, Krampfanfällen, Koma, Reye-ähnliche Symptomatik, Hepatopathie, Hyperammonämie neonataler Beginn möglich |
verlängerte Nüchternperioden vermeiden, regelmäßige Mahlzeiten, Glukose i.v. im Infekt bei Nahrungsverweigerung |
| Long-Chain-3-OHAcyl-CoA-Dehydrogenasemangel (LCHAD-Mangel) Defekt des mitochondr. trifunktionellen Proteins (MTP-Mangel) | selten | neonataler Beginn: hypoketotische Hypoglykämie, Laktatazidose, Cardiomyopathie, CK-Erhöhung; später: Reye-ähnliche Symptomatik, Polyneuropathie, Retinopathie | Diät mit starker Reduktion langkettiger Fette, Ersatz durch MCT-Fette, verlängerte Nüchternperioden vermeiden |
| Very-Long-Chain-Acyl-CoA-Dehydrogenase-Mangel (VLCAD-Mangel) | 1:88.000 | neonataler Beginn möglich wie LCHAD; sonst in den ersten Lebensmonaten Kardiomyopathie und Reye-ähnliche Symptomatik (Hepato-Enzephalopathie) | Diät mit Reduktion langkettiger Fette, Ersatz durch MCT-Fette, verlängerte Nüchternperioden vermeiden |
| Carnitin-Palmitoyl-Transferase-1 (CPT-1)-Mangel | selten | Fastenintoleranz, Reye-ähnliche Symptomatik (Hepato-Enzephalopathie) | kohlenhydratreiche, fettarme Ernährung, Ersatz durch MCT-Fette, verlängerte Nüchternperioden vermeiden |
| Carnitin-Palmitoyl-Transferase-2 (CPT-2)-Mangel | selten | neonatale Form mit Myopathie, Cardiomyopathie, Hepatopathie, Reye-ähnliche Symptomatik; adulte Form mit belastungsinduzierter Rhabdomyolyse | kohlenhydratreiche, fettarme Ernährung, Ersatz durch MCT-Fette, verlängerte Nüchternperioden vermeiden |
| Carnitin-Acylcarnitin-Translocase-Mangel (CACT-Mangel) | selten | hypoketotische Hypoglykämie, Myopathie, Cardiomyopathie | kohlenhydratreiche, fettarme Ernährung, Ersatz durch MCT-Fette, verlängerte Nüchternperioden vermeiden |
| Glutarazidurie Typ I (GA I) | 1:98.000 | Makrozephalie, frontotemporale Hirnatrophie, enzephalopathische Krisen, dyston-dyskinetische Bewegungsstörung | akut: Notfallbehandlung zur Vermeidung enzephalopathischer Krisen + Carnitin; langfristig: eiweißarme Diät + Carnitin |
| Isovalerianazidämie (IVA) | 1:79.000 | neonataler Beginn: Trinkschwäche, Erbrechen, Krampfanfälle, Enzephalopathie, Koma, ausgeprägte Ketoazidose, Schweißgeruch; mildere, spät oder nichtmanifestierende Formen sind häufig | akut: Eiweißzufuhr stoppen, anabole Stoffwechselsituation herstellen, Glycin + Carnitin p.o.; langfristig: eiweißarme Diät + Carnitin + Glycin p.o. |
| Tyrosinämie Typ I | 1:100.000 | häufig neonataler Beginn: schwere Leberfunktionsstörung, Gelbsucht, Blutungsneigung, Nierenfunktionsstörung | medikamentös (NTBC), Tyrosin-arme Diät |
| Zystische Fibrose (Mukoviszidose, CF) | 1:3.000 | Multisystemerkrankung (Lunge, Bauchspeicheldrüse), gehäufte Infekte, Gedeihstörung | Inhalation, Physiotherapie, Gabe von Enzymen und Antibiotika |
| Schwere kombinierte Immundefekte (SCID) | 1:32.500 | völliges Fehlen einer Immunabwehr: bereits im Säuglingsalter hohe Infektanfälligkeit gepaart mit Infektionskomplikationen | strenge hygienische Vorsichtsmaßnahmen; Knochenmarks- oder Stammzelltransplantation; Enzymersatztherapie; Verzicht auf Stillen, Lebendimpfung oder Transfusion unbehandelter Blutprodukte |
| Spinale Muskelatrophie (SMA) | 1:6.000 - 1:11.000 | zunehmende Muskelschwäche mit rückläufiger Entwicklung der Motorik und Einschränkung der Lungenfunktion. | medikamentös, molekular und symptomatisch (physiotherapeutisch, rehabilitativ, orthopädisch, psychologisch) |
| Sichelzellkrankheit | 1:3.950 | langfristig Organschädigung. Akute Komplikationen u. a. Hirninfarkt, Nierenversagen, Milzinfarkt, Blutvergiftung und Blutarmut. | Aufklärung und Anleitung zu Verhaltensmaßnahmen, Infektionsprophylaxe (z. B. Impfungen), Gabe von Hydroxycarbamid, gegebenenfalls Transfusionen und gegebenenfalls als weiterer Behandlungsansatz die Stammzelltransplantation |
Fehlermöglichkeiten und Einflussgrößen:
Stand: 13.02.2025